2022年06月25日讯 /生物谷BIOON/ --BioMarin制药公司近日宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议授予基因疗法Roctavian(valoctocogene roxaparvovec,valrox,BMN270)附条件上市许可(CAM):作为一种一次性输液,用于治疗重度A型血友病成人患者。具体为:无因子VIII抑制剂史且未检测到腺相关病毒血清型5(AAV5)抗体的重度A型血友病成人患者。
现在,CHMP的意见将递交至欧盟委员会(EC)审查,后者预计将在今年第三季度做出最终审查决定。据估计,在欧洲、中东、非洲,有超过20000名成人受到重度A型血友病的影响。Roctavian有潜力成为全球第一款治疗A型血友病的基因疗法。如果获批,Roctavian将标志着A型血友病治疗的一个重大里程碑,这种开创性的疗法,有潜力使患者实现“一劳永逸”的效果。
A型血友病也被称为因子VIII(FIII)缺乏或经典血友病,是一种由凝血因子VIII缺失或缺陷引起的X连锁遗传病,患者会反复发生持续或自发性出血,特别是在关节、肌肉或内脏器官中,长期可导致残疾。目前,重度A型血友病的护理标准是长期终身静脉输注凝血因子VIII,以维持血液中有足够的凝血因子VIII,以防止出血。
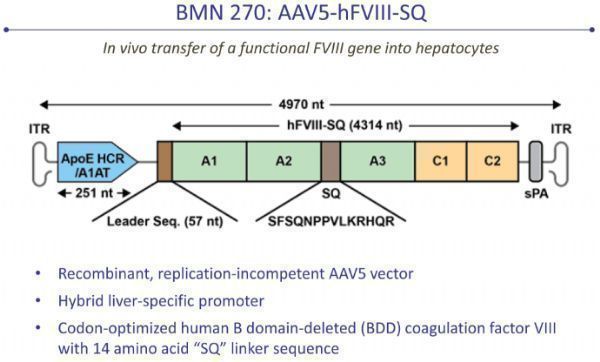
valrox是一种基于腺相关病毒(AAV)的基因疗法,通过单次输注,治疗重度A型血友病患者。该疗法通过递送凝血因子VIII的功能性基因,使患者身体能够自行产生VIII因子,从而减少持续预防性治疗(静脉输注因子VIII)的需求。
valoctocogene roxaparvovec(valrox,BMN270)
CHMP的积极审查意见,基于valrox临床开发项目的全部数据。该项目是A型血友病基因治疗研究中最广泛的项目,包括全球性GENEr8-1 3期研究的2年结果,以及1/2期剂量递增研究6e13 vg/kg剂量组随访5年、4e13 vg/kg剂量组随访4年的数据。
今年5月底,BioMarin公布了1/2期研究的最新结果,该研究代表了valrox的最长临床观察期,分别对6e13 vg/kg剂量组随访了6年、4e13 vg/kg剂量组随访了5年。结果显示,valrox具有持续的止血效果。
来自6e13 vg/kg剂量组随访6年的结果表明:在数据截止时,该剂量组所有患者均未使用预防性因子VIII治疗,平均累积年化出血率(ABR)仍然低于1,并大大低于基线水平;与基线相比,第6年的ABR为0.7,6年内平均累积ABR减少95%,因子VIII使用减少96%。
来自4e13 vg/kg剂量组随访5年的结果表明:在数据截止时,该剂量组所有患者均未使用预防性因子VIII治疗。在数据截止前6个月,一名患者暂时恢复预防性因子VIII治疗了一个月,之后在最后一次随访中无出血。与基线相比,4e13 vg/kg剂量组第5年的平均ABR为0.7,5年内平均累积ABR减少91%,因子VIII使用减少93%。
6e13 vg/kg剂量组和4e13 vg/kg剂量组中因子VIII活性水平的轨迹与最近几年的观察结果相符。(生物谷Bioon.com)